Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
ESPECIALIDADES MEDICINALES
Disposición 2673/99
Apruébanse normas para la implementación del Registro de Especialidades Medicinales.
Bs. As., 26/5/99
VISTO la Ley Nº 16.463 y sus Decretos Reglamentarios nros. 9763/64, 150/92, 1890/92 y 177/93, y el artículo 5º de la Resolución (M.S. y A.S.) nº 144/98, por el cual se faculta a esta Administración Nacional a dictar las Disposiciones complementarias de la misma, y
CONSIDERANDO:
Que para poder cumplir con este objetivo, se debe proceder al dictado de normas para implementar el Registro de Medicamentos Fitoterápicos.
Que el Instituto Nacional de Medicamentos y la Dirección de Asuntos Jurídicos han tomado la intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por el artículo 3º inciso a) y el artículo 8 inciso ll) del Decreto nº 1490/92.
Por ello,
EL DIRECTOR NACIONAL DE LA ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MEDICA
DISPONE:
Artículo 1º — Las solicitudes de inscripción en el Registro de Especialidades Medicinales creado por el Decreto Nº 150/92, de productos que respondan a la clasificación de medicamentos fitoterápicos, deberán ajustarse en su presentación a los requisitos técnicos establecidos en los Anexos I y II de la presente Disposición, con carácter de declaración jurada. Sólo se aceptará el registro de medicamentos fitoterápicos en formas farmacéuticas de administración oral o tópica.
La elaboración de medicamentos fitoterápicos deberá ser realizada en plantas aprobadas por Entidades Gubernamentales de Países consignados por el Decreto nº 150/92 (t.o. Decreto nº 177/93) que cumplan las Normas de Fabricación y Control de Calidad exigidas por la Autoridad Sanitaria Nacional.
Art. 2º — A los fines del cumplimiento de la presente Disposición, la Autoridad Sanitaria podrá efectuar inspecciones con o sin retiro de muestras en los Laboratorios elaboradores, fraccionadores y/o importadores titulares de productos o en empresas distribuidoras.
Art. 3º — Para el registro de medicamentos fitoterápicos elaborados en el país que resulten similares a otros ya inscriptos en el Registro Nacional de Medicamentos o autorizados para su consumo público en al menos uno de los Países mencionados en el Anexo I del Decreto nº 150/92 (t.o. Decreto nº 177/93) se deberá presentar la evidencia del similar y la información solicitada en el Anexo I de la presente disposición con excepción del punto 5. Quedan comprendidos, además, aquellos productos importados de países incluidos en el Anexo II del Decreto nº 150/92 (t.o. Decreto nº 177/93) que posean similares inscriptos en el Registro Nacional de Medicamentos o al menos en uno de los Países del Anexo I del Decreto nº 150/92 (t.o. Decreto nº 177/93) siempre que se acompañe la información requerida con el certificado "Sistema de la Calidad de los productos farmacéuticos objeto de comercio internacional OMS", o las siguientes evidencias de comercialización: a) Certificado de libre venta del producto expedido por la autoridad sanitaria del país invocado; y b) Envase y/o estuche del producto, indicativo del consumo en el país invocado con datos de su formulación, o Número de Certificado de Inscripción en el Registro Nacional de Medicamentos cuando se invoque el consumo en el País y Envase y/o estuche del producto.
Los documentos antes mencionados deberán presentarse en original o fotocopia autenticada, contar con la legalización correspondiente y si estuvieran en idioma distinto al oficial deberán acompañarse de la respectiva traducción realizada por traductor público matriculado.
Art. 4º — Para el registro de medicamentos fitoterápicos importados de al menos uno de los países del Anexo I del Decreto nº 150/92 (t.o. Decreto nº 177/93) deberá presentar la información solicitada en los puntos 4, 7.1.1, 7.2, 9, 11 y 12 del Anexo I de la presente Disposición, además de la certificación de venta en el país de origen; debidamente firmadas y legalizadas según los acuerdos internacionales.
Art. 5º — Para el registro de medicamentos fitoterápicos elaborados en el país o importados de países incluidos en el Anexo II del Decreto nº 150/92 (t.o. Decreto nº 177/93) siempre que el producto a registrar no tuviera similar inscripto en el Registro Nacional de Medicamentos o en países del Anexo I del Decreto nº 150/92 (t.o. Decreto nº 177/93), deberá presentar la información completa detallada en el Anexo I de la presente Disposición.
Art. 6º — Defínase como medicamento fitoterápico similar aquel que contiene la misma cantidad de droga vegetal y/o preparados de drogas, similar forma farmacéutica, la misma vía de administración, idéntico uso propuesto, la misma posología; pudiendo diferir en características tales como tamaño y forma, excipientes, período de vida útil y envase primario.
A efectos de cumplimentar la definición de producto similar se define como forma farmacéutica similar a aquella que se encuentra en el mismo estado físico (sólido o líquido) y se administra por la misma vía.
Art. 7º — Se aceptarán como productos similares aquellos que en el país de origen sean comercializados como medicamentos, medicamentos fitoterápicos o especialidades medicinales y que se ajusten a la definición de medicamentos fitoterápicos establecida por la Resolución (M.S. y A.S.) Nº 144/98 y que cumplimenten las exigencias de la presente Disposición.
Art. 8º — Los medicamentos fitoterápicos que en su fórmula contengan drogas vegetales incluidas en el Anexo III de la presente Disposición o sus preparaciones hidroalcohólicas, con un contenido alcohólico menor o igual de 30 % v/v, deberán cumplimentar el Anexo I, con excepción del punto 5 y 9.B del citado Anexo.
Art. 9º — El listado de drogas vegetales que conforman el Anexo III de la presente Disposición, reviste carácter provisorio y estará sujeto a permanente revisión por la Comisión conformada a tal fin.
Art. 10. — A los fines de justificar la registración de productos que contengan en su formulación como ingredientes sustancias activas químicamente definidas o sus mezclas, aun cuando fuesen constituyentes aislados de plantas, se establece que:
1) Si el fundamento del uso propuesto justifica la incorporación de una sustancia activa químicamente definida, la misma no deberá modificar o alterar el uso tradicional de la/s droga/s vegetal/es o preparación/es de droga/s vegetal/es constituyentes del producto a registrar. En este caso el registro del medicamento fitoterápico deberá cumplimentar el artículo 5 de la presente Disposición.
2) Si la incorporación de una sustancia activa por sí misma o por su concentración modifica o altera el uso tradicional de la/s droga/s vegetal/es o preparación/es de droga/s vegetal/es constituyentes del producto a registrar, el mismo no podrá registrarse como medicamento fitoterápico.
Art. 11. — A partir de la presentación de la solicitud de inscripción del medicamento fitoterápico, esta Administración Nacional tendrá un plazo de CIENTO VEINTE (120) días corridos para expedirse. Este plazo quedará interrumpido durante el período que el interesado demore la entrega de la información solicitada para el registro. Cumplido el plazo, el solicitante podrá requerir a la autoridad sanitaria que en el plazo de VEINTICUATRO (24) horas otorgue el acto administrativo por el que se autorice o deniegue la registración del producto. Las solicitudes de registro de productos que encuadren en el caso previsto por el artículo 5º de la presente, no estarán sujetas a plazo de evaluación alguno.
Art. 12. — Lo relativo a la vigencia, así como a la reinscripción del certificado de registro y autorización de venta de los medicamentos fitoterápicos, se regirá de acuerdo con lo establecido en las partes pertinentes del artículo 7º de la Ley 16.463.
Art. 13. — La cancelación de los certificados de registro y autorización de venta de medicamentos fitoterápicos se regirán por lo dispuesto en el artículo 8º de la Ley 16.463.
Art. 14. — El rotulado de los medicamentos fitoterápicos no podrá indicar usos o aplicaciones diferentes a los consignados en su solicitud de registro.
Lo relativo a la publicidad de este tipo de productos se regirá por lo dispuesto en el artículo 19 incisos c), d) y e) de la Ley 16.463, la Resolución (M.S. y A.S.) nº 1622/88 y sus disposiciones complementarias.
Art. 15. — Comuníquese a las Cámaras y demás Entidades Profesionales.
Art. 16. — Anótese; Notifíquese. Dése a la Dirección Nacional del Registro Oficial para su publicación. Cumplido, archívese PERMANENTE. — Pablo M. Bazerque.
ANEXO I
1) Fotocopia del Certificado de Inscripción y Habilitación del establecimiento, Nº de legajo bajo el cual se encuentra inscripto domicilio legal del mismo.
2) Nombre del Profesional a cargo de la Dirección Técnica y fotocopia autenticada de su autorización como tal.
3) Nombre del producto, forma farmacéutica, composición cuali y cuantitativa.
4) Fundamento del uso o de las indicaciones terapéuticas incluyendo posología basado en el uso tradicional y/o popular del producto y/o su comercialización prolongada y/o por referencias publicadas en literatura reconocida a nivel científico.
5) Ensayos farmacológicos que avalen el uso propuesto. Métodos in vivo o modelos alternativos adecuados para demostrar solamente la actividad terapéutica propuesta o información científica que lo demuestre.
6) Descripción del método de preparación.
Corresponde al proceso de fabricación del producto terminado a partir de las materias primas. La descripción debe incluir todas las etapas destinadas a obtener la forma farmacéutica y los detalles correspondientes al tratamiento de la materia prima. Si el método de preparación se inicia a partir de preparaciones de drogas vegetales, el tratamiento de la materia prima y sus controles, se informarán en el ítem correspondiente.
7) Control de materias primas.
7.1. Drogas Vegetales:
7.1.1. Monografía completa de la/s droga/s vegetal/es. Debe contener:
Nombre científico y nombre común o vulgar
Parte de la planta usada
Datos de provisión (Se recomienda. según punto 8.B del Anexo I de B.P.F.)
Fundamento del uso propuesto
Técnica de muestreo
Identificación botánica:
Macroscópica
Caracterización química de los componentes principales, valoración de los mismos cuando corresponda, y validación de los métodos propuestos.
Determinación de:
Pureza
Sustancias extrañas:
Orgánicas
Inorgánicas
Humedad
Cenizas
Pesticidas y agentes fumigantes (según Resoluciones que a tal efecto emita la Autoridad competente)
Radioactividad en caso de ser necesario
Determinación de metales pesados
Determinación de Arsénico
Contaminación microbiana incluyendo análisis de aflatoxinas (anexo IV de la presente disposición)
Método de valoración validado, cuando corresponda
7.1.2 Información toxicológica que garantice la seguridad de su uso.
7.2 Preparaciones de drogas vegetales.
Deben presentar:
Datos de provisión (Se recomienda según punto 8.B - Anexo I de B.P.F.)
Caracterización y Valoración de los componentes, cuando corresponda, con la correspondiente validación de los métodos empleados.
7.3. Excipientes:
Todos los componentes utilizados en la formulación de los medicamentos fitoterápicos deben ser controlados. Estos controles incluyen datos de procedencia, tamaño de los lotes, pruebas de identificación, pureza, calidad microbiológica y otras necesarias para determinar la calidad de los mismos.
7.4 Material de empaque
Del envase primario debe especificarse el tipo de material y los análisis necesarios para determinar la calidad y durabilidad del mismo. Deben ser adecuados para asegurar la calidad del producto durante el período de vida útil.
8) Controles llevados a cabo en la etapa intermedia de fabricación.
Se requerirán detalles de todos los ensayos de control, así como la frecuencia de realización, la justificación y descripción de estos controles.
9) Producto Terminado.
9.A. Controles sobre el producto terminado.
9.A.1. Técnicas de muestreo.
9.A.2. Ensayos farmacotécnicos con sus respectivas especificaciones.
9.A.3. Método de Caracterización.
9.A.4. Método de valoración de los ingredientes activos con su límite de aceptabilidad, cuando corresponda.
9.A.5. Control higiénico (los límites de aceptabilidad para las diferentes presentaciones se encuentran detallados en el Anexo II de la presente Disposición, que forma parte integral de la misma).
9.A.6. Estabilidad.
9.B. Documentación toxicológica: información que avale la seguridad de empleo del producto para el uso propuesto.
10) Condición de venta:
Venta Libre o Venta Bajo Receta dependiendo del fundamento del uso tradicional.
11) Proyecto de rótulos y etiquetas.
11.1. Nombre del laboratorio.
11.2. Dirección del mismo.
11.3. Nombre del Director Técnico.
11.4. Nombre del producto.
11.5. Nombre botánico o científico con indicación del nombre del autor de su clasificación y nombre/s común/es.
11.6. Parte usada.
11.7. Forma Farmacéutica.
11.8. Contenido por unidad de venta y/o porcentual de ingrediente/s activo/s indicando componente/s estandarizado/s cuando corresponda. Los excipientes también deben figurar.
11.9. Fecha de vencimiento.
11.10. Forma de conservación.
11.11. Número de lote/partida.
11.12. Medicamento Fitorápico "Tradicionalmente usado para...................."
11.13. Certificado Nº:..................
11.14. Condición de Venta.
12) Proyecto de prospecto: Será dirigido al paciente con un lenguaje suficientemente explicativo para la compresión por parte de la población en general.
Debe reproducir las inscripciones de rótulos y etiquetas además de
12.1 USO TRADICIONAL:
12.2. Forma de uso: explicando en forma detallada como el producto debe ser preparado y tomado a aplicado (superficie y zona de aplicación, con o sin oclusión). Indicando dosis máxima y pediátrica si las hubiera, tiempo máximo de empleo y momento de ingesta.
12.3 EFECTOS NO DESEADOS: Efectos adversos colocar los que se conocen, en caso de no registrarse antecedentes colocar la leyenda "NO SE CONOCEN"
12.4. PRECAUCIONES Y ADVERTENCIAS: "Este medicamento debe ser tomado con precaución en pacientes que padezcan ........ (a considerar según el tipo de medicamento fitoterápico) o que estén ingiriendo ........(a considerar según el tipo de medicamento fitoterápico)
12.5. SI UD. ESTA TOMANDO ALGUN MEDICAMENTO, CONSULTE CON SU MEDICO ANTES DE INGERIR ESTE PRODUCTO.
12.6 "En caso de presentar los siguientes síntomas........ debe consultar a su médico (a considerar según el tipo de medicamento fitoterápico).
12.7 "Si los síntomas persisten más de siete días deberá consultar a su médico (según el uso tradicional del medicamento fitoterápico).
12.8. EMBARAZO Y LACTANCIA: Todos los medicamentos fitoterápicos deben indicar utilizar con precaución salvo que presenten estudios que avalen la seguridad de su empleo en estos grupos de riesgo.
12.9. No deben ser administrados en menores de 2 años y/o en ancianos sin consultar con el médico.
12.10 CONTRAINDICACIONES: colocar las que se conocen y en caso de no registrarse antecedentes colocar la leyenda "NO SE CONOCEN".
12.11 En caso de sobredosificación consultar con los centros de intoxicación.
12.12. Mantener fuera del alcance de los niños.
12.13. Medicamento Fitoterápico autorizado por Certificado Nº:........
12.14. Nombre del laboratorio.
12.15. Dirección del mismo.
12.16. Nombre del Director Técnico.
ANEXO II
Criterios de Aceptabilidad microbiológica
Para materias primas y productos terminados para la preparación de tés medicinales
— Recuento de bacterias aeróbicas: No mayor de 107 ufc/g
— Recuento de Enterobacteriaceae: no mayor de 104 /g
— Investigación de Escherichia coli: ausencia en 1 gramo
— Investigación de Salmonella sp: ausencia en 1 gramo
— Investigación de Staphylococcus aureus: ausencia en 1 gramo
— Investigación de sulfito reductores: ausencia en 1 gramo
— Recuento de hongos y levaduras: no mayor de 104 ufc/g
— Determinación de aflatoxinas: límite de aceptabilidad 20 ug/kg para las cuatro aflatoxinas sumadas (B1, B2, G1 y G2) siempre que B1 no supere los 5 ug/Kg
Para medicamentos fitoterápicos de uso tópico:
— Recuento de bacterias aeróbicas: No mayor de 104 ufc/g
— Recuento de Enterobacteriaceae: no mayor de 102 /g
— Investigación de Staphylococcus aureus: ausencia en 1 gramo
— Investigación de Pseudomonas aeruginosa: ausencia en 1 gramo
— Recuento de hongos y levaduras: no mayor de 102 ufc/g
— Determinación de aflatoxinas: negativo
Para medicamentos fitoterápicos cuya forma farmacéutica sea de uso oral:
— Recuento de bacterias aeróbicas totales: No mayor de 104 ufc/g
— Recuento de Enterobacteriaceae: no mayor de 102 /g
— Investigación de Escherichia coli: ausencia en 1 gramo
— Investigación de Salmonella sp: ausencia en 1 gramo
— Investigación de Staphylococcus aureus: ausencia en 1 gramo
— Investigación de sulfito reductores: ausencia en 1 gramo
— Recuento de hongos y levaduras: no mayor de 102 ufc/g
— Determinación de aflatoxinas: negativo
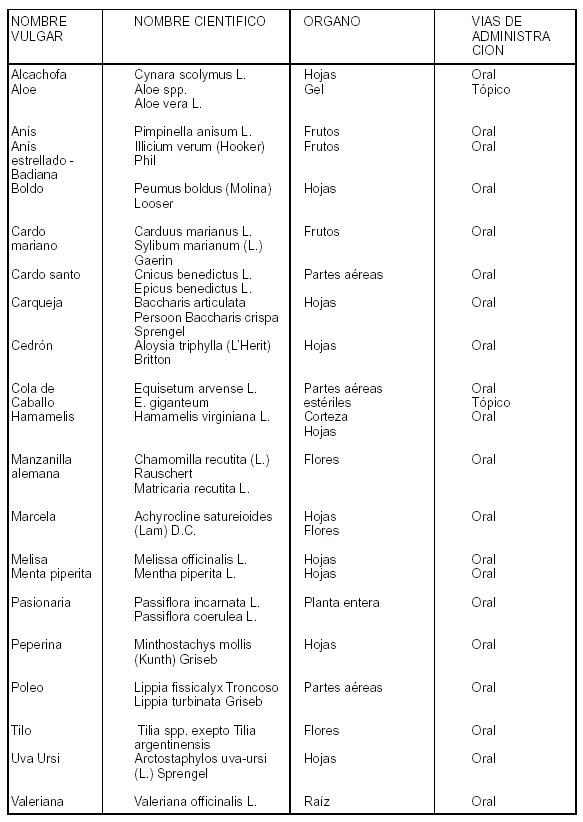
ANEXO III